AG Zelluläre Mechanismen der Melanomprogression
Leitung: PD Dr. med. Friedegund Meier
Tel.: 07071-2984599
Fax: 07071-294599
Email: friedegund.meier@med.uni-tuebingen.de
Anschrift: Universitäts-Hautklinik
Sektion Dermatologische Onkologie
Liebermeisterstr. 25
72076 Tübingen
Mitarbeiter
Dr. rer. nat. Silke Busch
Dr. med. Konstantinos Lasithiotakis
Heike Niessner, Biologie-Diplomandin
Evelyn Maczey, Medizinisch-technische Assistentin
Projekte
1. Blockade von Adhäsionsmolekülen als Strategie zur Reversion von invasivem und metastatischem Tumorwachstum beim malignen Melanom
Das übergeordnete Ziel unserer bisherigen Arbeit bestand darin, molekulare Ansatzpunkte für die Reversion invasiven Melanomwachstums und damit für die Entwicklung neuer Strategien zur wirksamen Behandlung des fortgeschrittenen Melanoms zu finden. Um die molekularen Mechanismen zu entschlüsseln, die entscheidend an der Tumorprogression des malignen Melanoms beteiligt sind, haben wir adenovirale Vektoren und Genetic Suppressor Elements (GSE) für den Gentransfer bzw. die Genmodulation eingesetzt, und ein in vitro Melanom-Modell entwickelt, um die biologischen Effekte der Genmanipulation in einem möglichst physiologischen Kontext zu evaluieren. Das von uns entwickelte in vitro Melanom-Modell basiert auf der Technik der organotypischen Kultur humaner Haut. Hierbei handelt es sich um artifizielle Haut, die aus isolierten humanen kutanen Zellpopulationen konstruiert wird. Wir haben beobachtet, dass Hautrekonstrukte bestehend aus humanen Fibroblasten und Keratinozyten menschliche Haut in vivo simulieren und humane melanozytäre Zellen unterschiedlicher Progressionsstufen in Hautrekonstrukten das biologische Verhalten in vivo rekapitulieren. Dieses in vitro Modell eignet sich daher hervorragend für die Untersuchung physiologischer und pathologischer Prozesse in der menschlichen Haut und bietet die Chance, Ansatzpunkte für die Therapie des malignen Melanoms in einem physiologischen Umfeld zu untersuchen. So konnten wir in organotypischer Hautkultur zeigen, dass die Expression des Wachstumsfaktors FGF-2 in humanen Melanozyten den Phänotyp eines frühen radial wachsenden Melanoms initiiert, die Überexpression der Adhäsionsmoleküle beta3 Integrin, MelCAM und L1 in radial wachsenden Melanomzellen die Progression zur vertikalen Wachstumsphase induziert, und die Herunterregulation des Adhäsionsmoleküls MelCAM invasives Melanomwachstum hemmt.
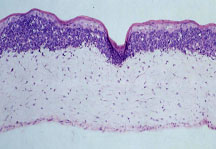
Abbildung 1: Melanomzellen, die aus humanen Primärmelanomen der frühen radialen Wachstumsphase isoliert wurden, wachsen in organotypischer Hautkultur im Bereich der epidermal-dermalen Junktionszone und zeigen keine Kompetenz für invasives Wachstum in die Dermis.
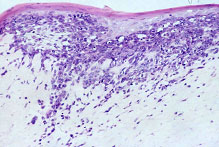
Abbildung 2 : Überexpression des Adhäsionsmoleküls MelCAM in Melanomzellen, die aus humanen Primärmelanomen der frühen radialen Wachstumsphase isoliert wurden, induziert aggressives invasives Wachstum der MelCAM-exprimierenden Melanomzellen in organotypischer Hautkultur.
Forschungsförderung:
Dr. Mildred Scheel Stiftung für Krebsforschung 10-2025-MeI
Literatur:
Siehe Pubmed unter meier-f, garbe und melanoma
2. Blockade der AKT- und MAPK-Signaltransduktionswege
als rationale Strategie zur Überwindung der Therapieresistenz
des metastasierten Melanoms
Beim malignen Melanom sind die RAS-RAF-MEK-ERK (MAPK)- und PI3K-AKT-mTOR (AKT)-Signaltransduktionswege über multiple Mechanismen konstitutiv aktiviert und tragen entscheidend zur Tumorprogression und Therapieresistenz bei. In unseren Voruntersuchungen haben wir sechs Melanommetastasen-Zelllinien mit der Fragestellung gescreent, ob 1) die Blockade der MAPK- und AKT-Signaltransduktionswege auf verschiedenen Ebenen als Mono- oder Kombinationstherapie Effekte auf Proliferation, Überleben und Invasion von Melanomzellen zeigt und 2) die Chemosensitivität von Melanomzellen durch Blockade der MAPK- und AKT-Signalwege erhöht werden kann. Die bisher vorliegenden in vitro Daten sprechen dafür, dass 1) die kombinierte Blockade der MAPK- und AKT-Signalwege eine vielversprechende Strategie für die wirksame Behandlung des metastasierten Melanoms darstellt und 2) Inhibitoren des AKT-Signaltransduktionsweges die Sensitivität von Melanomzellen gegenüber Chemotherapeutika erhöhen.
Im ersten Teil des Forschungsprojektes planen wir die erarbeiteten in vitro Daten in einem möglichst physiologischen Kontext in vitro und in vivo zu validieren. Hierfür möchten wir das in unserem Labor etablierte in vitro Melanommodell einsetzen, welches auf der Technik der organotypischen Kultur humaner Haut basiert. In vitro effektive Kombinationsstrategien sollen in SCID-Mäusen auf ihre therapeutische Aktivität gegen invasives und metastatisches Melanomwachstum untersucht werden. Im zweiten Teil des Forschungsprojektes möchten wir die Wirkmechanismen der effektiven Kombinationsstrategien untersuchen. Hierfür sollen die Veränderungen im Genom der Melanomzellen nach Behandlung mit den ausgewählten Kombinationsstrategien mittels Affymetrix-Microarray-Technologie detektiert werden. Ziel des Forschungsprojektes ist es, einen Beitrag für die Entwicklung rationaler Strategien für die Therapie des metastasierten Melanoms zu leisten.
Forschungsförderung:
Deutsche Krebshilfe, 10-2025-MeI
DAAD
Literatur:
Siehe Pubmed unter meier-f und melanoma